tal·li
tal·li
Química inorgànica
- ca tal·li, n m
- es talio, n m
- en thallium, n
- sbl Tl
Química inorgànica
Definició
Element del grup 13, del període 6 i del bloc p de la taula periòdica dels elements, de nombre atòmic 81 i massa atòmica 204,38.
Nota
-
Es coneixen fins a trenta-cinc isòtops del tal·li, dels quals només dos són estables (203Tl i 205Tl).
El tal·li es presenta com un metall de color blanc amb llustre metàl·lic, amb un punt de fusió de 304 ºC i un punt d'ebullició de 1.457 ºC.
És molt menys abundant que l'alumini en l'escorça terrestre, on es troba en forma de traces en minerals de zinc i de plom, i s'obté com a subproducte en el seu tractament.
Presenta els estats d'oxidació +1 i +3.
Químicament es diferencia de la resta d'elements del seu grup per l'estabilitat més gran de l'estat d'oxidació +1, per la qual cosa en molts aspectes la seva química és més similar a la dels metalls alcalins.
El fet que tant l'element com els seus compostos siguin extremament tòxics en limita l'ús.
tàntal
tàntal
Química inorgànica
- ca tàntal, n m
- es tántalo, n m
- en tantalum, n
- sbl Ta
Química inorgànica
Definició
Element del grup 5, del període 6 i del bloc d de la taula periòdica dels elements, de nombre atòmic 73 i massa atòmica 180,9479.
Nota
-
Es coneixen fins a trenta-tres isòtops del tàntal, dels quals dos són estables (180Ta i 181Ta).
El tàntal es presenta com un metall gris blavós, molt dur, dúctil, amb un punt de fusió de 2.980 ºC i un punt d'ebullició de 5.534 ºC.
És mitjanament abundant en l'escorça terrestre, on es troba principalment barrejat amb minerals de niobi.
És poc reactiu i químicament molt similar al niobi.
Presenta principalment els estats d'oxidació +2, +3, +4 i +5.
S'utilitza principalment per a aliatges i en la indústria electrònica.
taronja de metil
taronja de metil
Química analítica
- ca taronja de metil, n m
- ca 4-{[4-(dimetilamino)fenil]diazenil}benzensulfonat de sodi, n m sin. compl.
- ca heliantina, n f sin. compl.
- es 4-{[4-(dimetilamino)fenil]diazenil}bencensulfonato de sodio, n m
- es heliantina, n f
- es naranja de metilo, n m
- en helianthin, n
- en methyl orange, n
- en sodium 4-{[4-(dimethylamino)phenyl]diazenyl}benzenesulfonate, n
- for C14H14N3NaO3S
Química analítica
Definició
Indicador acidobàsic del grup dels azocolorants amb un interval de viratge comprès en entre pH 3,1 i pH 4,4.
Nota
-
En forma àcida, el taronja de metil és de color vermell, en canvi, en forma alcalina, és de color groc.
El taronja de metil és un àcid monobàsic, elèctricament neutre però amb una càrrega positiva i una de negativa (es tracta d'un zwitterió), amb un pKa en aigua de 3,5.
La preparació del taronja de metil es fa a partir de l'àcid sulfanílic i de la N,N-dimetilanilina. El producte que s'obté en la reacció de copulació és la forma àcida, de color vermell, que es coneix com a heliantina. En medi alcalí, es converteix en la sal de sodi, de color groc, per bé que abans passa per una tonalitat taronja, que és la que es coneix pròpiament com a taronja de metil.
taula de Mendeléiev
taula de Mendeléiev
Química inorgànica
- ca taula periòdica dels elements, n f
- ca taula de Mendeléiev, n f sin. compl.
- ca taula periòdica, n f sin. compl.
- es tabla de Mendeléyev, n f
- es tabla periódica, n f
- es tabla periódica de los elementos, n f
- en Mendeleev's table, n
- en periodic table, n
- en periodic table of the elements, n
Química inorgànica
Definició
Taula que conté els elements ordenats pel nombre atòmic en ordre ascendent d'acord amb la periodicitat de llurs propietats químiques i físiques.
Nota
-
La taula periòdica dels elements i la periodicitat que mostra es basen en la repetició de configuracions electròniques pels diversos àtoms a mesura que els nivells electrònics es van omplint segons el principi d'Aufbau.
Tal com es fa servir actualment, la taula periòdica dels elements està dividida en períodes, grups i blocs.
Els períodes fan referència a les set files horitzontals: les files primera, segona i tercera formen els períodes curts; les files quarta, cinquena, sisena i setena són els períodes llargs. Cada període correspon al valor del nombre quàntic principal dels electrons de la capa més externa. En general, els elements del segon període presenten unes propietats una mica diferents de les de la resta de períodes.
Els grups classifiquen els elements en diferents columnes, segons que tinguin la mateixa configuració electrònica en el darrer nivell d'energia.
Els blocs agrupen els elements segons el tipus d'orbital. Els elements del bloc s comprenen els grups 1 i 2; els elements del bloc d comprenen els grups del 3 al 12; els elements del bloc p comprenen els grups del 13 al 18, i els elements del bloc f no tenen les columnes numerades a causa de la gran similitud de propietats que presenten.
La taula periòdica dels elements té el seu origen en la taula que va proposar el químic rus Dimitri Mendeléiev l'any 1871, la qual es fonamentava en el fet que les propietats de tipus químic dels elements són una funció periòdica de la magnitud del seu nombre atòmic. Això va permetre ordenar els elements per ordre creixent de nombre atòmic, amb els elements que presenten similituds en columnes verticals.
taula periòdica
taula periòdica
Química inorgànica
- ca taula periòdica dels elements, n f
- ca taula de Mendeléiev, n f sin. compl.
- ca taula periòdica, n f sin. compl.
- es tabla de Mendeléyev, n f
- es tabla periódica, n f
- es tabla periódica de los elementos, n f
- en Mendeleev's table, n
- en periodic table, n
- en periodic table of the elements, n
Química inorgànica
Definició
Taula que conté els elements ordenats pel nombre atòmic en ordre ascendent d'acord amb la periodicitat de llurs propietats químiques i físiques.
Nota
-
La taula periòdica dels elements i la periodicitat que mostra es basen en la repetició de configuracions electròniques pels diversos àtoms a mesura que els nivells electrònics es van omplint segons el principi d'Aufbau.
Tal com es fa servir actualment, la taula periòdica dels elements està dividida en períodes, grups i blocs.
Els períodes fan referència a les set files horitzontals: les files primera, segona i tercera formen els períodes curts; les files quarta, cinquena, sisena i setena són els períodes llargs. Cada període correspon al valor del nombre quàntic principal dels electrons de la capa més externa. En general, els elements del segon període presenten unes propietats una mica diferents de les de la resta de períodes.
Els grups classifiquen els elements en diferents columnes, segons que tinguin la mateixa configuració electrònica en el darrer nivell d'energia.
Els blocs agrupen els elements segons el tipus d'orbital. Els elements del bloc s comprenen els grups 1 i 2; els elements del bloc d comprenen els grups del 3 al 12; els elements del bloc p comprenen els grups del 13 al 18, i els elements del bloc f no tenen les columnes numerades a causa de la gran similitud de propietats que presenten.
La taula periòdica dels elements té el seu origen en la taula que va proposar el químic rus Dimitri Mendeléiev l'any 1871, la qual es fonamentava en el fet que les propietats de tipus químic dels elements són una funció periòdica de la magnitud del seu nombre atòmic. Això va permetre ordenar els elements per ordre creixent de nombre atòmic, amb els elements que presenten similituds en columnes verticals.
taula periòdica dels elements
taula periòdica dels elements
Química inorgànica
- ca taula periòdica dels elements, n f
- ca taula de Mendeléiev, n f sin. compl.
- ca taula periòdica, n f sin. compl.
- es tabla de Mendeléyev, n f
- es tabla periódica, n f
- es tabla periódica de los elementos, n f
- en Mendeleev's table, n
- en periodic table, n
- en periodic table of the elements, n
Química inorgànica
Definició
Taula que conté els elements ordenats pel nombre atòmic en ordre ascendent d'acord amb la periodicitat de llurs propietats químiques i físiques.
Nota
-
La taula periòdica dels elements i la periodicitat que mostra es basen en la repetició de configuracions electròniques pels diversos àtoms a mesura que els nivells electrònics es van omplint segons el principi d'Aufbau.
Tal com es fa servir actualment, la taula periòdica dels elements està dividida en períodes, grups i blocs.
Els períodes fan referència a les set files horitzontals: les files primera, segona i tercera formen els períodes curts; les files quarta, cinquena, sisena i setena són els períodes llargs. Cada període correspon al valor del nombre quàntic principal dels electrons de la capa més externa. En general, els elements del segon període presenten unes propietats una mica diferents de les de la resta de períodes.
Els grups classifiquen els elements en diferents columnes, segons que tinguin la mateixa configuració electrònica en el darrer nivell d'energia.
Els blocs agrupen els elements segons el tipus d'orbital. Els elements del bloc s comprenen els grups 1 i 2; els elements del bloc d comprenen els grups del 3 al 12; els elements del bloc p comprenen els grups del 13 al 18, i els elements del bloc f no tenen les columnes numerades a causa de la gran similitud de propietats que presenten.
La taula periòdica dels elements té el seu origen en la taula que va proposar el químic rus Dimitri Mendeléiev l'any 1871, la qual es fonamentava en el fet que les propietats de tipus químic dels elements són una funció periòdica de la magnitud del seu nombre atòmic. Això va permetre ordenar els elements per ordre creixent de nombre atòmic, amb els elements que presenten similituds en columnes verticals.
tautòmer
tautòmer
Química orgànica
- ca tautòmer, n m
- es tautómero, n m
- en tautomer, n
Química orgànica
Definició
Cadascun dels isòmers estructurals d'un compost que difereixen entre si en la posició d'un hidrogen en α respecte d'un grup carbonil o respecte de l'àtom de carboni enllaçat a un grup imino i que estan en equilibri químic.
Nota
-
Els tautòmers no són estructures ressonants.
Vegeu també tautomeria cetoenòlica i tautomeria imina-enamina.
tautomeria
tautomeria
Química orgànica
- ca tautomeria, n f
- ca tautomerisme, n m sin. compl.
- es tautomería, n f
- es tautomerismo, n m
- en tauromerism, n
Química orgànica
Definició
Isomeria dinàmica en la qual els tautòmers existeixen en equilibri i poden interconvertir-se mitjançant processos reversibles.
Nota
- La composició d'equilibri d'un sistema tautomèric és determinada, en cada temperatura, per la diferència d'energia lliure entre els tautòmers.
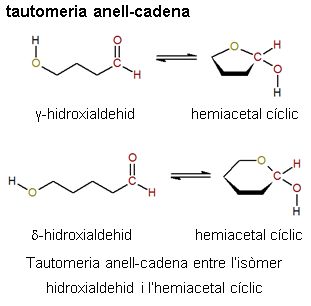
tautomeria anell-cadena
tautomeria anell-cadena
Química orgànica
- ca tautomeria anell-cadena, n f
- es tautomería anillo-cadena, n f
- en ring-chain tautomerism, n
Química orgànica
Definició
Tautomeria entre un compost de cadena oberta i la forma cíclica corresponent.
Nota
- És un exemple de tautomeria anell-cadena l'equilibri que es dona en els sucres entre els γ-hidroxialdehids o els δ-hidroxialdehids i els hemiacetals cíclics de cinc o sis membres (vegeu la imatge).
tautomeria cetoenòlica
tautomeria cetoenòlica
Química orgànica
- ca tautomeria cetoenòlica, n f
- es tautomería ceto-enólica, n f
- en keto-enol tautomerism, n
Química orgànica
Definició
Tautomeria que presenten els compostos carbonílics que contenen un enllaç doble carboni-oxigen i que tenen un o més hidrògens en posició α.
Nota
-
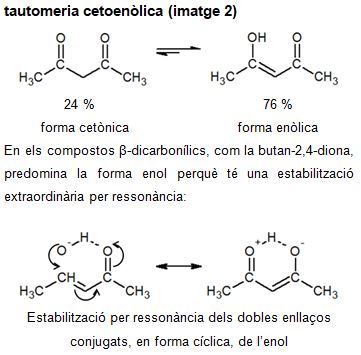
En els compostos monocarbonílics senzills, com la cetona i l'acetaldehid, el tautòmer que conté l'enllaç doble carboni-oxigen és el que predomina i el que es considera forma cetònica (vegeu la imatge 1).
De fet, la forma enòlica es inferior a l'1 % en l'acetona i no es pot detectar en el cas de l'acetaldehid. Aquesta estabilitat més gran de les formes cetòniques en els compostos monocarbonílics s'atribueix a la diferència de l'energia d'enllaç entre l'enllaç π carboni-oxigen (87 Kcal/mol) i l'enllaç π carboni-carboni (60 kcal/mol).
Pel que fa als compostos β-dicarbonílics, que tenen dos grups carbonil separats per un carboni saturat, la quantitat de la forma enòlica en l'equilibri és molt superior (vegeu la imatge 2).
En la transformació d'alguns compostos té un gran interès la formació de l'enol, ja que sovint hi és present en una baixa proporció, i es recorre a la catàlisi per a afavorir-lo.