-è
-è
Química orgànica
- ca -è, sfx
- es -eno, sfx
- en -ene, sfx
Química orgànica
Definició
Forma sufixada que es fa servir per a indicar la presència d'un enllaç doble carboni-carboni en un hidrocarbur insaturat.
Nota
-
Si hi ha més d'un enllaç doble carboni-carboni, es fan servir les terminacions -diè, -triè, etc., i s'indica per a cada enllaç doble el número de l'àtom de carboni enllaçat doblement que té la posició més baixa (pent-2-è, CH3CH2CH=CHCH3).
Quan en un compost hi ha enllaços dobles i enllaços triples, s'han d'enumerar de manera que en conjunt tinguin els números més baixos possibles (pent-3-en-1-í, CH3CH=CHC≡CH). En el cas de més d'una opció, s'atribueix la posició més baixa a l'enllaç doble (pent-1-en-4-í, CH≡CCH2CH=CH2).
Quan el sufix -è no apareix en última posició en el nom d'un compost, s'hi afegeix una n etimològica (-en-).
Vegeu també alquè.
(E)-
(E)-
Química orgànica
- ca trans-, pfx
- ca (E)-, pfx sin. compl.
- es (E)-, pfx
- es trans-, pfx
- en (E)-, pfx
- en trans-, pfx
Química orgànica
Definició
Forma prefixada que indica la relació estereoquímica entre dos àtoms o agrupacions d'àtoms d'un compost que estan units a dos àtoms adjacents connectats per un enllaç doble o continguts en un anell i que es troben en sentits oposats respecte a un pla.
Nota
-
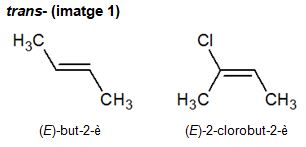
Per exemple, el trans-but-2-è té els dos metils en sentits oposats. Dels dos grups als quals es troba unit cadascun dels àtoms de carboni que participen en l'enllaç doble, el grup preferent és aquell que té l'àtom de nombre atòmic més gran. Si no és possible distingir-ho entre els àtoms units directament, cal comparar els àtoms que els segueixen fins a trobar un grup preferent.
La configuració trans s'oposa a la configuració cis.
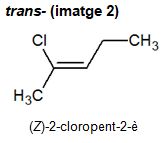
Quan la forma trans- és ambigua per als alquens, se substitueix per (E)- (vegeu les imatges 1 i 2). La E d'aquest prefix prové de la denominació alemanya entgegen ('oposat').
Quan trans- i (E)- no funcionen com a prefixos sinó com a paraules independents amb valor d'adjectiu s'escriuen amb cursiva i sense guionet i, en el cas de (E)-, també sense parèntesis.
Vegeu cis-.
ebullició
ebullició
Enginyeria química
- ca ebullició, n f
- es ebullición, n f
- en boiling, n
- en ebullition, n
Enginyeria química
Definició
Vaporització que es produeix en tota la massa d'un líquid.
ebullioscòpia
ebullioscòpia
Química física
- ca ebullioscòpia, n f
- es ebulloscopia, n f
- es ebulloscopía, n f
- en ebullioscopy, n
Química física
Definició
Mètode per a determinar la massa molecular relativa d'un compost en solució a partir de l'observació experimental de l'ascens ebullioscòpic.
Nota
- Vegeu també crioscòpia.
ECD
ECD
Química analítica
- ca detector de captura d'electrons, n m
- ca ECD, n m sigla
- es detector de captura de electrones, n m
- es ECD, n m sigla
- en electron capture detector, n
- en ECD, n sigla
Química analítica
Definició
Detector selectiu que mesura la variació de la intensitat de corrent d'un feix d'electrons quan es posa en contacte amb espècies que tenen afinitat amb els electrons lliures, utilitzat en cromatografia de gasos.
Nota
-
Un detector de captura d'electrons és molt sensible a molècules que contenen grups funcionals electronegatius, com halògens, grups peroxo, quinones i grups nitro.
En un detector de captura d'electrons, l'efluent de la columna cromatogràfica passa sobre un emissor β, normalment níquel 63. Un electró de l'emissor β provoca la ionització del gas portador (sovint, nitrogen) i la producció d'una ràfega d'electrons. D'aquest procés d'ionització, en absència d'espècies orgàniques, en resulta un corrent d'electrons constant entre un parell d'elèctrodes. No obstant això, el corrent d'electrons disminueix significativament en presència de molècules orgàniques que tendeixen a capturar electrons. La mesura de la variació del corrent d'electrons permetrà quantificar l'anàlit.
La sigla ECD correspon a la denominació anglesa electron capture detector ('detector de captura d'electrons').
EDTA
EDTA
Química analítica
- ca àcid etilendiaminatetraacètic, n m
- ca EDTA, n m sigla
- es ácido etilendiaminotetraacético, n m
- es EDTA, n m sigla
- en ethylendiaminetetraacetic acid, n
- en EDTA, n sigla
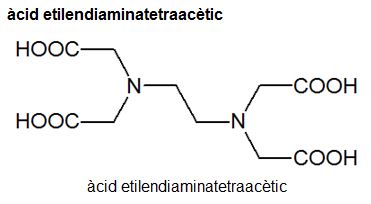
- for (HOOCCH2)2NCH2CH2N(CH2COOH)2
Química analítica
Definició
Àcid aminopolicarboxílic que és l'agent complexant més utilitzat.
Nota
-
Tot i que l'àcid etilendiaminatetraacètic és un àcid polipròtic, presenta comportament d'àcid feble amb pK1 = 2,0; pK2 = 2,67; pK3 = 6,16 i pK4 = 10,26. Aquests valors fan palès que dos dels hidrògens àcids es perden, en dissolució aquosa, molt més fàcilment que els altres dos.
A més dels quatre hidrògens àcids, cada àtom de nitrogen de l'àcid etilendiaminatetraacètic conté un parell d'electrons no enllaçants, la qual cosa fa que aquesta molècula presenti sis llocs per on pot arribar a enllaçar-se amb un catió. Aquest agent complexant es representa, en les reaccions, com a YH4. En conseqüència, YH3−, YH22−, YH3−, Y4− en representen les formes ionitzades.
Com que l'àcid etilendiaminatetraacètic és poc soluble en aigua, no s'utilitza per a preparar solucions patró. Tampoc no resulta pràctic emprar la sal tetrasòdica (Na4Y) per a aquesta finalitat, ja que, en solució aquosa, presenta una hidròlisi molt forta. La forma més útil per a aplicacions analítiques és la sal disòdica (Na2YH2 · 2 H2O). Aquesta sal, una vegada s'ha dessecat a 80 ºC té el comportament d'un patró, per la qual cosa se'n preparen solucions directament per pesada. En el cas que es dessequi entre 120 i 140 ºC, s'obté la sal lliure d'aigua de cristal·lització (Na2YH2), la qual també es pot emprar com a patró. Les solucions aquoses d'aquesta sal presenten un pH = 4,8 i són estables durant mesos, si es conserven en recipients de polietilè o de vidre borosilicatat.
En general, l'àcid etilendiaminatetraacètic reacciona amb ions metàl·lics de valència 2+, 3+ o 4+, amb els quals forma complexos d'estequiometria 1:1. Així: (a) M2+ + H2Y2− → MY2− + 2 H+, (b) M3+ + H2Y2− → MY− + 2 H+, (c) M4+ + H2Y2− → MY + 2 H+. La formació d'aquests complexos depèn molt del pH, de manera que habitualment, s'utilitza una solució amortidora per tal de regular-lo. A més, hi ha una correlació aproximada entre la càrrega del catió i l'estabilitat del complex resultant, de manera que els complexos de l'àcid etilendiaminatetraacètic amb els cations divalents són molt estables en solucions bàsiques i en solucions lleugerament àcides; els complexos dels cations trivalents són estables en l'interval de pH comprès entre 1 i 2; els complexos dels cations tetravalents són estables a valors de pH menors que 1.
La sigla EDTA correspon a la denominació anglesa ethylendiaminetetraacetic acid ('àcid etilendiaminatetraacètic').
efecte Auger
efecte Auger
Química física
- ca efecte Auger, n m
- es efecto Auger, n m
- en Auger effect, n
Química física
Definició
Procés d'emissió d'electrons d'orbitals atòmics de baixa energia per efecte de la radiació i la posterior ocupació de les posicions vacants per electrons més externs amb producció de fotons.
Nota
- L'emissió del primer electró allibera energia, la qual cosa indueix l'àtom a emetre un segon electró, l'electró Auger. L'energia amb la qual surt alliberat l'electró Auger és característica de cada àtom; en aquest fet rau, precisament, el fonament de l'espectroscòpia d'electrons Auger.
efecte de l'ió comú
efecte de l'ió comú
Química analítica
- ca efecte de l'ió comú, n m
- es efecto del ion común, n m
- en common-ion effect, n
Química analítica
Definició
Variació del grau de dissociació d'un àcid feble, d'una base feble o d'una sal quan s'afegeix a la solució en què es troben un dels ions en què es dissocien.
Nota
-
En la dissociació d'un àcid feble, la variació de la concentració d'una de les espècies provoca un desplaçament de l'equilibri HA
A− + H+ per a compensar aquesta variació. Així, si s'augmenta la concentració de l'àcid feble, l'equilibri es desplaça cap a la dreta i la dissociació de l'àcid feble augmenta; si s'augmenta la concentració de l'anió, l'equilibri es desplaça cap a l'esquerra i la dissociació de l'àcid feble disminueix. Si, a través de la presència d'un àcid fort, s'incrementa la concentració del protó, l'equilibri també es desplaça cap a l'esquerra i la dissociació de l'àcid feble disminueix. En els casos que la dissociació disminueix es produeix l'efecte de l'ió comú.
efecte Doppler
efecte Doppler
Química física
- ca efecte Doppler, n m
- es efecto Doppler, n m
- en Doppler effect, n
Química física
Definició
Fenomen en virtut del qual la freqüència d'una ona acústica que arriba al receptor és diferent de la freqüència de l'ona acústica que surt de l'emissor, si el receptor o l'emissor es troben en moviment relatiu respecte al medi on es propaga l'ona.
Nota
- En l'efecte Doppler, si l'objecte s'allunya la freqüència percebuda és més baixa, mentre que si l'objecte s'apropa la freqüència percebuda és més elevada.
efecte estèric
efecte estèric
Química orgànica
- ca efecte estèric, n m
- es efecto estérico, n m
- en steric effect, n
Química orgànica
Definició
Influència que exerceixen els àtoms o les agrupacions d'àtoms d'una molècula en l'estabilitat i el comportament químic d'un compost a causa del seu volum i de la geometria que adopten, la qual pot modificar el tipus de reacció i l'extensió de la reacció.
Nota
- Habitualment, estan més afavorides les configuracions que presenten interaccions mínimes. Aquestes interaccions depenen fonamentalment de dos factors: l'impediment estèric i les forces de van der Waals. Així, els alquens trans són més estables que els cis, ja que, en els primers, l'efecte estèric és menor perquè en l'isòmer trans els àtoms o agrupacions d'àtoms de més volum es troben al més allunyats possible.