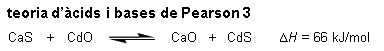teoria d'àcids i bases de Pearson
teoria d'àcids i bases de Pearson
- ca teoria d'àcids i bases de Pearson, n f
- ca teoria d'àcids i bases durs i tous, n f sin. compl.
- es concepto ácido-base de Pearson, n m
- es teoría ácido-base de Pearson, n f
- es teoría ácido-base duro-blando, n f
- es teoría HSAB, n f
- en HSAB concept, n
- en HSAB theory, n
- en Pearson acid base concept, n
Química analítica, Química inorgànica
Definició
Teoria d'àcids i bases que es fonamenta en l'estabilitat dels complexos que formen.
Nota
-
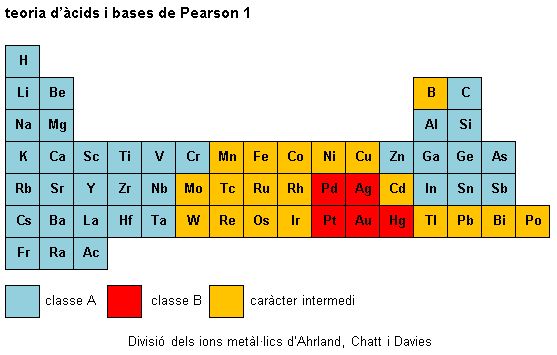
A partir de les dades de constants d'equilibri, s'ha observat que els metalls més pesants del bloc p i els últims metalls del bloc d (Cu+, Ag+, Au+, Cd2+, Hg2+, Pd2+, Pt2+, coneguts com a ions metàl·lics de classe B) formen complexos més estables amb els àtoms donadors fòsfor, sofre i iode, segons els ordres d'estabilitats N << P >> As > Sb; O << S > Se » Te i F < Cl < Br < I.
En canvi, els metalls més lleugers del bloc s i el bloc p i els primers metalls del bloc d (Al3+, Co3+, Fe3+, Ti4+, coneguts com a ions metàl·lics de classe A) formen complexos més estables d'acord amb els ordres d'àtoms donadors N >> P > As > Sb; F > Cl > Br > I i O > S > Se > Te.
La proposta de Pearson és que aquests fets empírics es poden generalitzar mitjançant els conceptes de àcid dur, àcid tou, base dura i base tova; segons els quals una base dura, com ara els lligands amb nitrogen, oxigen o fluor, es coordina millor amb un àcid dur, com ara Al3+, Co3+ o Fe3+, i una base tova, com ara els lligands amb fòsfor, sofre o iode, es coordina millor amb un àcid tou, com ara Cu+, Ag+, Au+, Cd2+ o Hg2+.
Ahrland, Chatt i Davies van fer una divisió de la taula periòdica segons la classe a la qual pertanyen els elements que poden actuar com a àcids (vegeu la imatge teoria d'àcids i bases de Pearson 1). Els ions metàl·lics de caràcter intermedi de vegades ho són pel fet que poden presentar diferents estats d'oxidació.
En aquest context, dur i tou són mesures de la polaritzabilitat dels àcids i les bases, en què per polaritzabilitat s'entén la capacitat que el seu núvol de densitat electrònica pugui ser deformat per una altra espècie. Cal remarcar que dur i tou són termes relatius, ja que es tracta d'un model comparatiu. Així, quan es diu que un àcid és dur, en realitat el que es vol dir és que és més dur que altres àcids.
Aquest model permet predir el signe correcte per al canvi d'entalpia associat a una reacció d'equilibri, com es mostra a la imatge teoria d'àcids i bases de Pearson 2, en què d significa dur, t significa tou, a indica que és un àcid i b indica que és una base. Per exemple, el que es mostra a la imatge teoria d'àcids i bases de Pearson 3. Aquest model també resulta molt útil en geoquímica, ja que permet predir en quina forma es trobaran determinats cations a l'escorça terrestre, ja siguin òxids, sulfurs, etc.
La sigla HSAB correspon a la denominació anglesa hard and soft acids and bases ('àcids i bases durs i tous').